Pentru înţelegerea caracteristicilor oceanului este necesar, în prealabil, să se cunoască proprietăţile apei de mare. Caracteristicile generale fizico-chimice, biologice sunt derivate în mod direct din cele ale structurii moleculei apei.
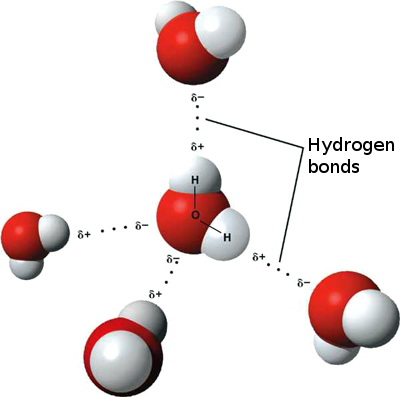 Fiecare moleculă de apă este alcătuită din doi atomi de hidrogen şi un atom de oxigen, care formează împreună un dipol tipic. Atomii de hidrogen, cu sarcină + sunt legaţi de atomul de oxigen, cu sarcină - la un unghi de 105 grade, printr-o legătură covalentă. Între mai multe molecule de apă, atomii de hidrogen sunt legaţi de cei de oxigen mult mai slab ca cei din interiorul unei singure molecule (de 20 de ori mai slab), printr-o legătură de hidrogen.
Fiecare moleculă de apă este alcătuită din doi atomi de hidrogen şi un atom de oxigen, care formează împreună un dipol tipic. Atomii de hidrogen, cu sarcină + sunt legaţi de atomul de oxigen, cu sarcină - la un unghi de 105 grade, printr-o legătură covalentă. Între mai multe molecule de apă, atomii de hidrogen sunt legaţi de cei de oxigen mult mai slab ca cei din interiorul unei singure molecule (de 20 de ori mai slab), printr-o legătură de hidrogen. Apa este una dintre puţinele substanţe care există în toate cele trei stări de agregare: lichidă, solidă şi gazoasă. Structura unei molecule de gheaţă este însă una diferită. Ca orice structură cristalină, aceasta este oarecum rigidă, permiţând doar vibraţii dar nu şi o deplasare liberă ca în cazul stării lichide.
Apa este una dintre puţinele substanţe care există în toate cele trei stări de agregare: lichidă, solidă şi gazoasă. Structura unei molecule de gheaţă este însă una diferită. Ca orice structură cristalină, aceasta este oarecum rigidă, permiţând doar vibraţii dar nu şi o deplasare liberă ca în cazul stării lichide.Densitatea gheţii la temperatura de 0 gr. Celsius este de 0,92 g/cmc, în timp ce a apei în stare lichidă este de 1g/cmc. Din acest motiv o bucată de gheaţă pluteşte pe apă.
Sărurile din apa de mare.
În interiorul apei de mare există mai multe săruri dizolvate care-i determină acesteia o serie de proprietăţi fizice, şi foarte important, îi controlează densitatea. Din cele peste 70 de elementele existente în apă doar 6 dintre ele reprezintă mai mult de 99% din toate sărurile: Cl, Na, Mg, Ca, K şi S.
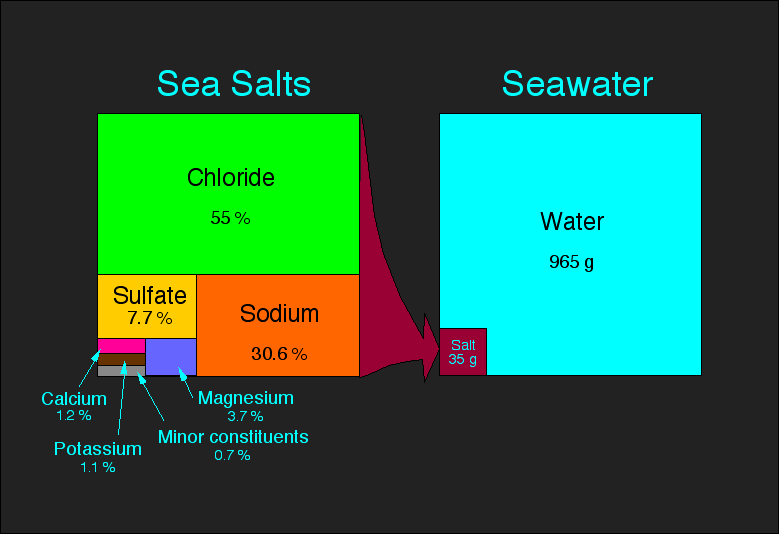 Totalitatea sărurilor dizolvate într-un litru de apă indică salinitatea soluţiei respective, care se măsoară în grame. Conductivitatea electrică reprezintă o metodă de măsurare a salinităţii, existând o corelaţie directă între aceşti doi parametri.
Totalitatea sărurilor dizolvate într-un litru de apă indică salinitatea soluţiei respective, care se măsoară în grame. Conductivitatea electrică reprezintă o metodă de măsurare a salinităţii, existând o corelaţie directă între aceşti doi parametri.Gazele dizolvate în apa de mare.
În cadrul apei de mare există o cantitate mică de gaze dizolvate, datorită scimbului permanent existent între ocean şi atmosfera terestră. Spunem că apa de mare este saturată în gaze atunci când pentru o anumită temperatură şi salinitate, cantitatea totală de gaze ce intră în apă egalează cantitatea gazelor ce ies din aceasta, într-un anumit interval de timp. Creşterea temperaturii şi scăderea salinităţii vor duce la creşterea cantităţii totale de gaze dizolvate. Cea mai mare proporţie a gazelor dizolvate revine: azotului (48%), oxigenului (36%) şi CO2 (15%) și argonului (1%). Pe măsură ce apele de suprafaţă coboară în adâncime, proporţia gazelor dizolvate se poate modifica ca urmare a difuziei moleculare sau prin amestecul apelor cu alte mase care conţin o cantitate diferită de gaze. Concentraţia acestor gaze dizolvate constituie una dintre proprietăţile conservative ale apei de mare, modificările putând apare doar ca urmare a unor procese bio-chimice. Ciclul azotului în apa de mare.

Particule existente în apa de mare.
Cele mai multe particulele din ocean există din cauza organismelor marine. O bună parte dintre ele servesc ca hrană pentru alte vieţuitoare de adâncime. Pentru a atinge fundul oceanului unele particule au nevoie de ani de zile. O altă categorie provine din râurile şi fluviile care se varsă în ocean, sau sunt aduse de vânturi de pe continente., ori pot rezulta din contactul apelor cu scoarţa. Prin procesul de dizolvare al unor astfel de particule se poate ajunge la modificări ale compoziţiei apelor de adâncime.
Proprietăţile fizice ale apei de mare.
Salinitatea determină cele mai importante caracteristici fizice ale apelor din oceane. Cu cât valoarea ei va fi mai ridicată cu atât temperatura de îngheţ va fi mai coborâtă. Dacă temperatura de îngheţ a apei dulci este de 0 grade Celsius, o apă de mare cu salinitatea de 35 psu va îngheţa în jur de -2 grade. Descreşterea punctului de îngheţ este liniară din acest motiv la o salinitate de 17 psu temperatura va fi de aproape -1 grade.
Densitatea apei de mare.
Temperatura, salinitatea şi presiunea controlează densitatea apei din mări şi oceane. Diferenţele apărute în cadrul densităţii determină direcţia şi viteza curenţilor de adîncime. Unitatea de măsură: grame/cmc. Pentru o temperatură constantă (de ex: 30 grade C) o schimbare a salinităţii de la 34 la 35 psu va reprezenta o modificare a densităţii de la 1,021 la 1,022.
Relaţia dintre temperatură şi salinitate în determinarea densităţii
În funcţie de valoarea densităţii este controlată adâncimea la care masele de apă respective se află în ocean.
Apa Oceanului Planetar se raceşte în ultmii ani? La această întrebare a răspuns Josh Willis, dovedind cum uneori te poţi înşela atunci când datele din măsurători sunt inexacte. Pentru a afla răspunsul citiţi întreg articolul aici.
În funcţie de valoarea densităţii este controlată adâncimea la care masele de apă respective se află în ocean.
Apa Oceanului Planetar se raceşte în ultmii ani? La această întrebare a răspuns Josh Willis, dovedind cum uneori te poţi înşela atunci când datele din măsurători sunt inexacte. Pentru a afla răspunsul citiţi întreg articolul aici.

Niciun comentariu:
Trimiteți un comentariu